-
(환경) 메탄 가스과학과 테크놀로지/환경 2016. 1. 9. 01:32
출처: https://ko.wikipedia.org/wiki/%EB%A9%94%ED%85%8C%EC%9D%B8
메테인
위키백과, 우리 모두의 백과사전.메테인(methane) 
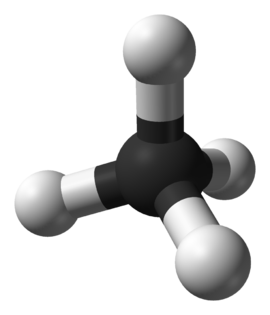
일반적인 성질 IUPAC 이름 Methane 화학식 CH₄ 분자식 CH4 CAS 번호 74-82-8 PubChem 297 ChemSpider 291 물리적 성질 분자량 16.042 g/mol 녹는점 90.65 K (-182.5 °C, -296.5 °F) 끓는점 111.55 K (-161.6 °C, -258.88 °F) 밀도 0.717 kg/m3 (gas, 0 °C)
415 kg/m3 (liquid) g/cm3물에 대한 용해도 35 mg/L (17 °C) g/100 ml 열화학적 성질 안전성 메테인(영어: methane 메세인[*] [mɛθeɪn], CH4) 또는 메탄(독일어: methan)은 가장 간단한 탄소 화합물로, 탄소 하나에 수소 4개가 붙어 있다. 분자량은 16이다. 녹는점은 -183 ℃, 끓는점은 -162℃이므로, 상온에서 기체이다.
자연적으로는 유기물이 물 속에서 부패, 발효할 때 생기므로 늪지대의 바닥 등에서 발생한다. 또 석탄층 속에 함유되어 석탄 갱내에서 발생하여 공기와 섞여 폭발을 일으킬 때도 있다. 천연가스나 석탄가스의 주성분을 이룬다.
C-H의 결합 길이는 0.110nm이며, C-H의 결합 사이의 결합각은 109.5°이며, 무극성 분자이다.
순수한 메테인은 냄새가 없으나, 산업용으로 사용할 때 누출 여부 확인을 위해 냄새가 나는 다른 화합물을 일부 첨가하여 판매한다.
천연 가스의 주성분으로, 연료로 많이 사용된다. 메탄 분자 하나를 태우면 이산화탄소 한 분자와 물 두 분자가 생성된다. 반응식은 다음과 같다.
- CH4 + 2O2 → CO2 + 2H2O
온실 효과의 원인이기도 하며, 같은 질량의 이산화탄소보다 23배의 효과가 있다.
메테인의 치환반응[편집]
메테인은 햇빛존재하에 상온의 염소와 반응하여 치환반응을 하는데, 중심의 탄소와 공유결합을 하고있는 수소가 차례로 염소와 치환되어 성질이 다른 분자로 바뀌어간다.
바뀌는 순서는 다음과 같다.
바깥 고리[편집]

위키미디어 공용에 관련 미디어 자료와 분류가 있습니다. [보이기] 알케인 (CnH2n+2)[보이기] 기후 변화와 지구 온난화'과학과 테크놀로지 > 환경' 카테고리의 다른 글
(환경) Dirty, Dangerous and Expensive: The Truth About Nuclear Power (영문) (0) 2016.01.10 (환경) Methane (영문) (0) 2016.01.09 (환경/미국) LA 메탄 가스 누출 사고: 이번 사고는 재앙이 아니라고 말하는 회사 (0) 2016.01.09 (환경) 억만장자에서 환경보호활동가 된 노스페이스 창립자 더글라스 톰킨스 (0) 2015.12.10 (환경) 환경문제에 위선적 태도로 비판 받는 영국정부 (0) 2015.12.08